Кислота против основания
Содержание
- Содержание: Разница между кислотой и основанием
- Сравнительная таблица
- Какие кислоты?
- Каковы основы?
- Ключевые отличия
- Заключение
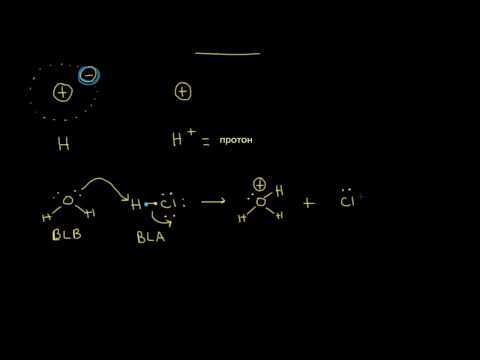
Различие между кислотой и основанием может быть указано, поскольку кислоты являются едкими веществами, способными отдавать протон и принимать электрон от другого вещества, тогда как основания являются едкими веществами, способными принимать протон и отдавать электрон другие вещества.

Кислоты и основания являются типами едких веществ. Кислоты представляют собой тип ионных соединений, которые диссоциируют в воде и выделяют ион водорода (Н +). Основания также являются разновидностью ионных соединений. Они также распадаются в воде и обозначают гидроксильный ион (ОН-). Это означает, что кислоты, являющиеся соединениями при растворении в воде, образуют раствор с концентрацией ионов водорода, превышающей чистую воду. И наоборот, основания - это соединения, которые при растворении в воде дают раствор с концентрацией иона водорода меньше, чем в чистой воде.
По шкале рН кислоты имеют рН от 0 до менее 7, в то время как основания имеют рН более 7-14. Кислоты могут встречаться в любом физическом состоянии, то есть в твердых веществах, жидкостях или газах в зависимости от температуры, давления и других физических свойств. условия. Основания в основном находятся в твердой форме, за исключением аммиака, который находится в газообразном состоянии. Кислоты чувствуют себя липкими, в то время как основы имеют скользкую консистенцию, потому что они реагируют с маслами наших рук. Вкус кислот ощущается кислым, а у основ - горьким. Кислота реагирует с металлами. Кислоты выделяют газообразный водород после реакции, в то время как основания реагируют с маслами и жирами. Сила кислот зависит от концентрации ионов водорода. Чем больше концентрация ионов водорода, тем сильнее кислоты. Сила оснований зависит от концентрации гидроксильных ионов. Чем больше концентрация гидроксильных ионов, тем сильнее основание.
Кислоты заряжены положительно благодаря наличию положительно заряженных ионов водорода, в то время как основания имеют отрицательный заряд на них из-за присутствия в них ионов ОН-. Кислоты не показывают изменения цвета с фенолфталеином, в то время как основы делают его розовым.Химическая формула кислот начинается с H, (водород), например, HCL (соляная кислота), H2SO4 (серная кислота). Но этому правилу не следует уксусная кислота (CH3COOH), химическая формула которой не начинается с H. Химическая формула оснований заканчивается на OH. Например, гидроксид натрия (NaOH). Кислоты и основания также показывают реакцию с лакмусом. Кислоты меняют синюю лакмусовую бумагу на красную, в то время как основы меняют лакмусовую бумагу на синий Как кислоты, так и основания могут проводить электричество из-за диссоциации свободных ионов между ними.
Кислоты используются для очистки ржавых металлов, при производстве удобрений, в качестве добавок в пищевые продукты и напитки, в качестве электролитов в батареях и при переработке минералов. Они также используются в качестве консервантов, в качестве газированных напитков, в кожевенной промышленности, в производстве газированных напитков и ароматизаторов для пищевых продуктов и т. Д.
Основы имеют возможность удалять пятна, поэтому они используются в моющих средствах, моющих средствах, средствах для стирки и чистки духовок. Они также используются в лекарствах для желудка, то есть в антацидах, в дезодорантах для подмышек и для нейтрализации кислот.
Содержание: Разница между кислотой и основанием
- Сравнительная таблица
- Какие кислоты?
- Каковы основы?
- Ключевые отличия
- Заключение
Сравнительная таблица
| основа | кислота | База |
| Концепция Аррениуса | Кислоты - это соединения, которые способны растворять ионы Н + при растворении в воде. | Основание - это вещество, способное отдавать ионы ОН- при растворении в воде. |
| Лоури Бронстед Концепция | Кислоты обладают способностью отдавать протоны другим веществам. | Основания обладают способностью принимать протоны от других веществ. |
| Концепция Льюиса | Вещества, которые являются электрофилами, имеют свободную орбиталь и способны принимать пару электронов, называются кислотами Льюиса. | Вещества, которые являются нуклеофилами, имеют неподеленную пару электронов и способны пожертвовать пару электронов, называются основаниями Льюиса. |
| Реакция с водой | Когда кислоту смешивают с водой, получают раствор с концентрацией ионов H +, превышающей чистую воду. | Когда основание смешивается с водой, получается раствор с концентрацией H +, меньшей, чем у чистой воды. |
| диапазон pH | Их рН колеблется от 0 до менее 7. | Их рН варьируется от 7 до 14. |
| Физическое состояние | Они могут возникать в любом физическом состоянии, то есть в жидкости, твердом теле или газе. | Они встречаются в основном в твердом состоянии, за исключением аммиака, который находится в газообразном состоянии. |
| Реакция с лакмусовой бумагой | Они превращают лакмусовую бумагу в красный. | Они превращают лакмусовую бумагу в синий. |
| Реакция с фенолфталеином | Они не показывают реакции с фенолфталеином. | Они превращают фенолфталеин в розовый. |
| Химическая формула | Химическая формула кислот начинается с Н, например, HNO3 для азотной кислоты, H2SO4 для серной кислоты, HCL для соляной кислоты. | Их химическая формула заканчивается на ОН, например, NaOH для гидроксида натрия, KOH для гидроксида калия и Ca (OH) 2 для гидроксида кальция. |
| консистенция | Кислоты липкие на ощупь. У них кислый вкус. | Основы скользкие на ощупь. У них горький вкус. |
| Пользы | Кислоты используются для очистки ржавых металлов, в качестве добавок в пищу и напитки, в качестве электролитов в батареях, в удобрениях и кожевенной промышленности. | Основы используются в моющих средствах от пятен, дезодорантах ям для рук, моющих средствах, антацидных лекарствах и для нейтрализации кислот. |
Какие кислоты?
Слово «кислота» происходит от латинского слова «acere», что означает «кислый». Кислота - это ионное и коррозионное вещество, которое способно отдавать ион водорода, принимать пару электронов или жертвовать протон. Сила кислоты измеряется концентрацией ионов H +. Коррозионное вещество - это вещество, которое повреждает или разрушает другие вещества, соприкасающиеся с ним. Чем больше концентрация ионов водорода, тем сильнее кислота. Кислотность измеряется по шкале pH. Он находится в диапазоне от 0 до менее 7. Вещества, имеющие рН ниже, являются более кислыми и наоборот.
Ионные соединения - это те соединения, которые заряжены либо положительно, либо отрицательно. Кислоты заряжены положительно благодаря ионам водорода.
Сильные кислоты - это те, которые полностью растворяются в воде, например, HCL, HNO3 и H2SO4. Недельные кислоты - это те, которые не полностью растворяются в воде, например, Уксусная кислота (CH3COOH).
Генетически важные материалы, то есть ДНК (дезоксирибонуклеиновая кислота) и РНК (рибонуклеиновая кислота), также являются кислотами. Жизнь невозможна без них. Уксус является широко используемой бытовой кислотой.
Каковы основы?
Основания - это ионные и коррозийные вещества, которые способны принимать ион водорода, давать пару электронов или принимать протон из любого другого вещества. Сила оснований измеряется концентрацией ионов ОН-. Чем больше концентрация ионов OH-, тем сильнее основание. Диапазон значений от 7 до 14 по шкале рН. Высокий pH указывает на большую прочность основания. Основания заряжены отрицательно из-за присутствия ионов ОН-.
Сильные основания - это те основания, которые полностью диссоциируют в воде, например, NaOH, то есть гидроксид натрия, и KOH, то есть гидроксид калия.
Недельные базы - это те, которые не полностью диссоциированы в воде, например NH3, то есть аммиак. Он не имеет гидроксид-иона и образует недельную основу только при растворении в воде. Другими примерами обычно используемых домашних основ являются бура, пищевая сода и магнезиальное молоко (используется как лекарство для желудка).
Ключевые отличия
Основные различия между кислотой и основанием приведены ниже:
- Кислоты и основания оба являются едкими веществами. Кислота обладает способностью отдавать ион водорода или протон или принимать пару электронов. Основания способны принимать ион водорода или протон или давать пару электронов.
- Кислоты имеют кислый вкус и липкие на ощупь. Основы имеют горький вкус и скользкие на ощупь.
- Химическая формула кислот начинается с Н, например, HCL, HNO3, в то время как концентрация оснований заканчивается у OH, например КОН, NaOH и др.
- Кислоты превращают лакмусовую бумагу в красную, а в основание - в синий
- По шкале рН кислоты имеют рН менее 7, в то время как основания имеют рН более 7.
Заключение
Кислоты и основа имеют основное значение как в химии, так и в нашей повседневной жизни. Стоит знать о них. В вышеупомянутой статье мы обсудили различия в кислотах и основаниях, их физико-химических свойствах и трех теориях, чтобы понять их природу.